Imitando la naturaleza para afrontar la transición medioambiental verde
Desde el inicio de la era industrial, las actividades antropogénicas han estresado continuamente los ecosistemas. El ritmo frenético de los avances tecnológicos durante los siglos XX y XXI y la creciente contaminación ambiental son las dos caras de la misma moneda. Aunque la naturaleza siempre ha encontrado formas inteligentes y sofisticadas de paliar los desequilibrios ambientales, la tasa de producción y liberación de sustancias nocivas por parte de la humanidad está desfasada en comparación con la autoadaptación de la biomaquina (1).
Como consecuencia, la acumulación de gases de efecto invernadero y contaminantes persistentes han perturbado el equilibrio de los ciclos atmosférico, del suelo y del agua. Por lo tanto, el cambio a un entorno de cero toxicidad debe ir acompañado no solo de la eliminación de estas sustancias nocivas del medio ambiente, sino de la producción ecológica de biocombustibles para reducir la huella de carbono de las actividades humanas (2).
“Cualquier ser, si varía, aunque sea levemente, de alguna manera rentable para sí mismo… tendrá más posibilidades de sobrevivir y, por lo tanto, será seleccionado de forma natural. A partir del fuerte principio de herencia, cualquier variedad seleccionada tenderá a propagar su forma nueva y modificada". - Charles Robert Darwin (1809-1882), El origen de las especies, 1860
La naturaleza enfrenta la contaminación ambiental atrapando y transformando químicos y gases nocivos en sustancias bio-útiles. Dentro de la compleja biomecánica capaz de desplegar esta función, las enzimas, y específicamente las metaloenzimas, tienen papeles predominantes (3,4). Aunque la evolución directa de la bioingeniería ha adaptado rápidamente enzimas y metaloenzimas a aplicaciones industriales, estos biosistemas chocan con una barrera insuperable: la falta de estabilidad química y térmica para funcionar fuera de la ventana habitual donde la vida es posible. Esto se debe principalmente a que la belleza y complejidad de las estructuras tridimensionales de enzimas y proteínas se asemeja a interacciones débiles que se rompen cuando se exponen a condiciones químicas o térmicamente estrictas (5).
Las enzimas son estructuras tridimensionales complejas que se forman a partir del plegamiento de largas cadenas de aminoácidos, también llamadas péptidos (Figura 1a-c). Por lo tanto, los andamios flexibles y dinámicos de las enzimas están formados principalmente por las interacciones débiles establecidas por los residuos de aminoácidos dentro de las secuencias de péptidos (Figura 1d). La estructura se estabiliza y decora aún más con moléculas de agua, grupos prostéticos y cofactores alojados dentro de la enzima; que además juegan papeles estructurales y funcionales críticos (Figura 1e).
La versatilidad de las enzimas ha evolucionado para dar forma a bolsillos activos extraordinariamente sofisticados capaces de reconocer y transformar moléculas individuales mediante mecanismos de bloqueo de llave. En el caso específico de las metaloproteínas, el bolsillo activo asigna iones metálicos individuales o agrupados que se coordinan con los residuos de aminoácidos que provienen del andamio de la enzima. En términos generales, los bio-metales alojados dentro de estas estructuras complejas poseen esferas de coordinación tensas que normalmente se completan con especies lábiles (es decir, agua o grupos de unión de aminoácidos). Tras la eliminación de los grupos de coordinación lábiles, el núcleo de metaloenzima se activa dando lugar a sitios catalíticos abiertos altamente reactivos (Figura 1e) (6).
Pero no solo importa la primera coraza de coordinación de metal. La ubicación y disposición específicas de los grupos residuales de aminoácidos, dispuestos en las segundas distancias de pseudocoordinación, afina la actividad catalítica de los bio-metales al alterar sus propiedades electrónicas y redox. Paralelamente, esta segunda capa también modula el campo eléctrico y la naturaleza hidrófoba / hidrófila de la bolsa enzimática que rodea el núcleo metálico. La combinación de la decoración de la superficie del bolsillo y la plasticidad de la estructura general ayudan a adaptar específicamente su forma y función para reconocer, activar y transformar los sustratos de alojamiento (Figura 1e) (7).
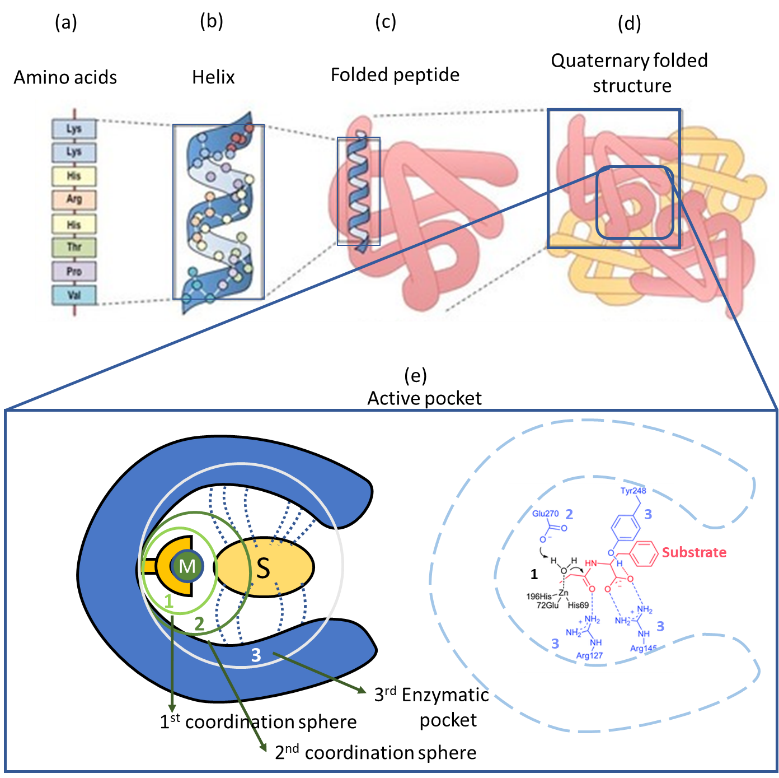
Figura 1.- (a) Bloques de construcción de aminoácidos dispuestos en una (b) configuración de hélice. (c) Estructura terciaria del péptido plegado. (d) estructura cuaternaria de la enzima compuesta por cuatro subestructuras terciarias de péptidos plegados. (e) Ilustración esquemática de bolsas activas en metaloenzimas.
Las enzimas y metaloenzimas se clasifican en función de sus funcionalidades individuales en seis grupos principales: oxidorreductasas (iones Fe, Cu y Mo), transferasas (metales Mg, Mn y Co), hidrolasas (iones Ca, Zn, Co, Mn y Mg), liasas (basadas principalmente en Ca, Mg, Mn, Co y Zn), isomerasas (biometales Mn, Co y Fe) y ligasas (iones Mg y Mn) (Figura 2). Al abarcar sus funciones individuales, las enzimas participan en procesos tan hermosos y sofisticados como la fotosíntesis o el transporte y la regulación de túnel de iones / electrones. Estos son solo algunos de los múltiples ejemplos que requieren una actividad enzimática acoplada en un modo de cascada autorregulado y reversible, donde la salida de una actividad enzimática (es decir, luz, electrones, protones de moléculas orgánicas) alimenta la entrada de la siguiente (8).
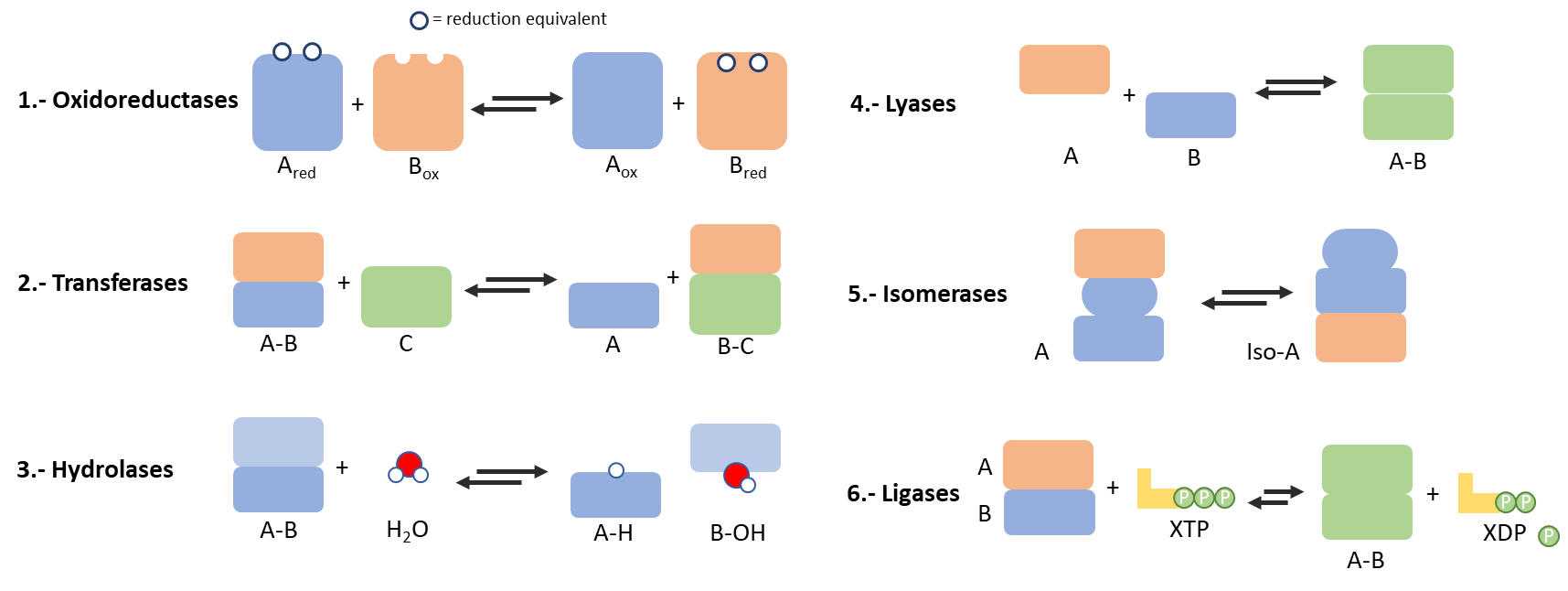
Figura 2.- Clasificación de enzimas en función de su función catalítica.
Se han desplegado intensos esfuerzos de investigación para expandir la bioquímica de metaloproteínas con el fin de obtener sistemas robustos capaces de trabajar fuera de la estrecha ventana donde se produce el despliegue de las enzimas. Por un lado, los bioquímicos han podido ampliar la ventana de aplicación de enzimas para fines industriales y medioambientales, pero su estabilidad aún se limita a temperaturas suaves, acidez y condiciones de disolvente 9. Además, la inmovilización y/o encapsulación de enzimas y metaloenzimas en andamios robustos ha abierto la perspectiva para mejorar aún más su estabilidad a largo plazo (10). Por otro lado, muchos investigadores han explorado el ensamblaje de catalizadores homogéneos basados en compuestos de coordinación, que se asemejan a la estructura de núcleo metálico simplificada de las enzimas. Pero aún así, como catalizadores homogéneos, estos compuestos de coordinación muestran limitaciones similares a las de las propias enzimas. En un tercer enfoque, la comunidad investigadora ha intentado replicar los núcleos activos de las metaloenzimas en muchos soportes poliméricos, biopoliméricos e inorgánicos, aunque el control sobre la segunda capa de coordinación de los bio-metales, así como sobre la forma y química de los Los bolsillos catalíticos siguen siendo un desafío (11).
En este punto surge una pregunta: ¿puede la comunidad de investigadores imitar las funciones de las metaloenzimas mientras mejora su estabilidad cuando su especificidad y eficacia dependen de estructuras tridimensionales flexibles estabilizadas por interacciones débiles?
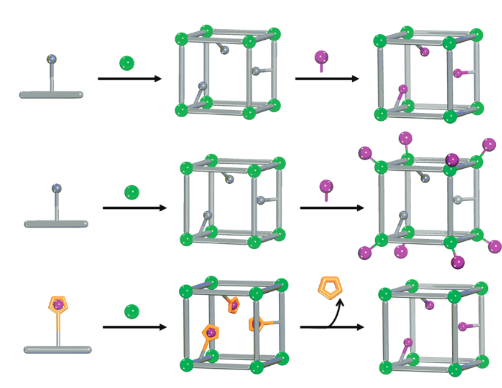
Figura 3. Estrategias genéricas para la modificación post-sintética de MOF. Adaptado con permiso de SM Cohen de Cohen, SM (2012) Postsynthetic Methods for the Functionalization of Metal-Organic Frameworks Chemical Reviews 112 (2), 970-1000 DOI: 10.1021 / cr200179u
Aquí es donde entran en juego los marcos metal-orgánicos (MOF). Los MOF son materiales altamente porosos y ordenados construidos a partir de oxo-clústeres metálicos y enlazadores orgánicos conectados a través de fuertes puentes covalentes (12). Dependiendo de la conectividad, geometría y longitud de los bloques de construcción de los clústeres y enlazadores, la topología final, la porosidad y la química de los poros de los materiales MOF pueden ajustarse para aproximarse a la bioquímica de las metaloenzimas. Por ejemplo, hasta la fecha la química reticular ha permitido 1) construir materiales MOF a partir de construcciones bio-metálicas y / o bio-orgánicas (es decir, péptidos, aminoácidos, porfirinas…) que se asemejan a las bolsas y/o grupos protésicos de ciertas metaloenzimas (13), 2) intercambiar o unir iones metálicos dentro del marco para acercarse a los modos de unión metal-ligando de las bolsas de metaloenzimas, y 3) incorporar residuos de aminoácidos como puntales funcionales para acercarse más y sintonizar las funciones de metaloenzimas artificiales (Figura 3) (14). Además, a pesar de sus estructuras altamente robustas, algunos MOF exhiben estructuras asombrosamente flexibles capaces de readaptar su porosidad general y apertura de poros dependiendo del hospedador asignado dentro de los poros. De manera similar al andamio 3D flexible de enzimas, algunos MOF pueden acercarse a los mecanismos de reconocimiento de moléculas huésped distorsionando y readaptando sus marcos (15).
En esta etapa, la mayor parte de las investigaciones realizadas en metaloenzimas basadas en MOF se han centrado en la construcción o instalación de núcleos metálicos similares a los que se encuentran en los biocatalizadores. También se han realizado algunos esfuerzos para ajustar los modos de coordinación de los iones metálicos instalados dentro de los MOF. A pesar de que nos encontramos en una etapa incipiente de este enfoque de investigación, los resultados iniciales son realmente prometedores, lo que demuestra el potencial de estos sistemas para la producción de combustibles verdes y con fines de remediación ambiental. Tres son las principales áreas de aplicación en las que se han evaluado los sistemas de metaloenzimas MOF hasta la fecha:
- Descarbonización global a través de actividad bienzimática similar a la anhidrasa: captura de dióxido de carbono y transformación en carbonato (actividad hidrolasa tipo III).
- Producción de combustible verde imitando enzimas de tipo monooxigenasa e hidrogenasa: reducción de protones para producir hidrógeno / oxidación catalítica de alcanos (actividad enzimática oxidorreductasa de tipo I).
- Oxidación e inactivación de productos químicos altamente peligrosos como fenoles, pesticidas y agentes de guerra (actividades oxidorreductasa tipo I e hidrolasa tipo III).
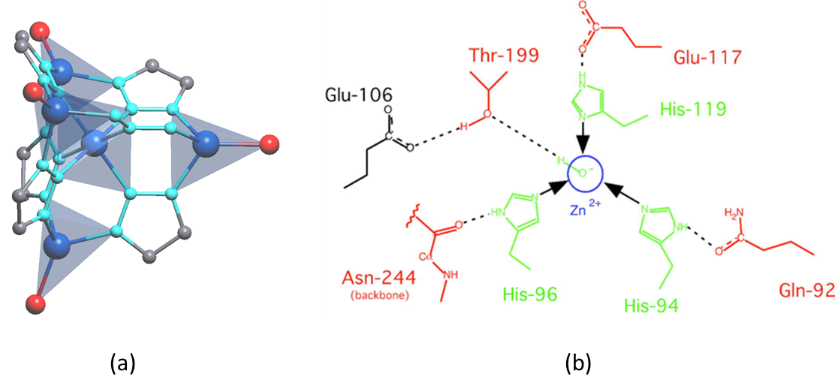
Figura 4. (a) Grupos de tetrazolato de zinc de MFU-4- I- (OH) que se asemejan al centro activo de (b) metaloproteína de anhidrasa carbónica.
M. Dincă y colaboradores informaron de un ejemplo notable de un MOF con actividad enzimática sobre la captura y transformación de dióxido de carbono (16). Para diseñar un MOF con actividad similar a la anhidrasa carbónica (CA), modificaron racionalmente los nodos metálicos del conocido MFU-4l MOF ( unidades terminales N3Zn‒Cl convertidas en unidades N3Zn - OH) ( Figura 4). Al seguir este enfoque, aumentan su parecido con las enzimas similares a las anhidrasas carbónicas, que catalizan la hidratación y deshidratación del dióxido de carbono (H2O + CO2 ↔ HCO3‒ + H+). El material resultante adsorbe una gran cantidad de CO2 de manera reversible (N3Zn‒OH ↔ N3Zn‒OCOOH), pero en paralelo, también es activo para la hidrólisis del acetato de 4-nitrofenilo, imitando la actividad del CA. Dada la capacidad de absorción significativa (3.41 mmol g-1 a 298 K) y el costo energético limitado requerido para la regeneración, este material ofrece una gran promesa para la captura y secuestro de CO2 .
La conversión directa de alcanos en portadores de energía oxigenados fácilmente condensables (metanol, etanol…) es conceptualmente una reacción clave en la conversión descentralizada de gas de esquisto. Si bien el metano se puede convertir en metanol a temperaturas muy altas, la vía de oxidación directa y altamente selectiva del metano a metanol a temperatura ambiente es una cuestión de metaloenzimas.
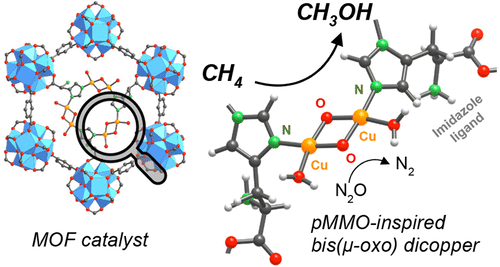
Figura 5. Entorno de poros de MOF-808 funcionalizado con residuos de histidina. Estructura local de unidades diméricas de cobre instaladas dentro del espacio poroso MOF-808. Fuente: Baek, Jayeon, et al. Journal of the American Chemical Society 140.51 (2018): 18208-18216. Reproducido con permiso.
También se ha demostrado que la oxidación de alcanos a bajas temperaturas es factible en MOF de tipo metaloenzima. A partir de MOF con grupos de metales que se asemejan a los restos metal-oxo que se encuentran en las hierro-oxidasas, DJ Xiao y sus colaboradores demostraron que los iones de hierro de alto giro de Fe2 (dobdc) MOF son capaces de transformar el etano en etanol al 75% con un Selectividad 25: 1 sobre acetaldehído. Los sitios metálicos abiertos de hierro en Fe2 (dobdc) funcionan como centros reactivos para activar el N2O e impulsar la oxidación posterior del etano a etanol (17). De manera similar, varios MOF basados en circonio micro y mesoporosos han servido como matrices de alojamiento para la instalación de especies de hierro y cobre monoméricas, diméricas y triméricas capaces de desplegar actividad de tipo metano monooxigenasa a 85 ºC (18,19). Yendo un paso más allá, J. Baek y sus colaboradores pudieron instalar residuos de histidina coordinados con unidades de cobre dimérico dentro del trimesato de circonio MOF-808 (Figura 5). En una disposición cercana a la observada en la metano monooxigenasa de cobre, el material mostró la productividad y selectividad de metanol más altas reportadas (71,8 µmol/g) en tratamientos isotérmicos a 150 °C (20).
![Figura 6. Clústeres de [FeFe] dentro de los enlazadores orgánicos del marco UiO-66.](https://mappingignorance.org/app/uploads/2021/07/figure-6.png)
Figura 6. Clústeres de [FeFe] dentro de los enlazadores orgánicos del marco UiO-66.
En el contexto de los esquemas de conversión de luz a combustible, los complejos binucleares FeFe también se han inmovilizado en matrices MOF de circonio para la producción verde de hidrógeno. El sitio similar a la hidrogenasa FeFe se ha estabilizado dentro del marco poroso del MOF de tereftalato de circonio UiO-66 que desencadena la reducción electro y fotoquímica de protones a hidrógeno (Figura 6) (21). La estabilidad y el rendimiento catalítico del MOF tipo hidrogenasa superan con mucho el del catalizador homogéneo FeFe, lo que demuestra los beneficios de la protección de la capa de MOF de los centros catalíticos activos.
La capacidad oxidativa de las metaloenzimas también se puede aplicar para una rápida desintoxicación o degradación de contaminantes persistentes , como fenoles o compuestos fluorados. Bioinspirados por esta función, J. Wu y sus colaboradores aplicaron un enfoque inspirado en la ingeniería de proteínas para impulsar la actividad similar a la oxidasa de varios MOF a base de hierro mediante la instalación de funciones de extracción de electrones en los pilares orgánicos del marco (22). Siguiendo esta estrategia inteligente, los autores pudieron alterar la segunda capa de coordinación de los iones metálicos, mejorando en paralelo la actividad de tipo oxidasa del marco de MOF, que logró una oxidación rápida de contaminantes modelo de tipo fenol. Paralelamente, las características estructurales de varios MOF de circonio y cerio se asemejan a una actividad similar a la de la fosforasterasa para hidrolizar compuestos fosfoorgánicos como plaguicidas y agentes de guerra (23).
En conclusión, la química reticular proporciona estructuras química y térmicamente estables donde los núcleos de biocatalizadores metálicos se pueden replicar e instalar. En conjunto, los sistemas reticulares similares a las metaloenzimas son muy prometedores para expandir la ventana operativa y la diversidad de biocatalizadores. No obstante, es importante señalar que hasta la fecha solo dos de las seis funciones enzimáticas principales se han replicado en las metaloenzimas MOF: actividades oxidorreductasa e hidrolasa. Hasta ahora, los MOF de bio-metalocatalizadores que exhiben actividades de transferasa, liasa, isomerasa o ligasa están sin explorar, aunque la aplicación de MOF quirales en catálisis asimétrica y separación enantiomérica es muy prometedora para expandir los potenciales de la química reticular para imitar actividades enzimáticas.
La perspectiva de aplicar la química reticular para imitar sistemas enzimáticos está en su etapa incipiente. Todavía hay espacio para mejorar los sistemas de metaloenzimas similares a MOF para diseñar con precisión no solo los núcleos de biocoordinación de metales de las enzimas, sino también para ajustar su segunda capa de coordinación y el bolsillo circundante mediante agrupaciones y codificación multivariante de enlazador. El diseño racional de poros asimétricos con propiedades anisotrópicas (es decir, campo eléctrico, naturaleza hidrófila/hidrófoba…) será un hito clave para abordar la gran especificidad de las enzimas para reconocer sustratos individuales. En paralelo, lejos de la química de funcionalización pre o post sintética habitual de las MOF, la impresión molecular podría tener un gran potencial para controlar la ubicación específica y la disposición de los residuos de aminoácidos dentro del espacio poroso de las MOF.
Será fascinante descubrir si una vez establecidos los antecedentes de la química de las metaloenzimas reticulares, el enfoque de evolución directa que se suele aplicar para desarrollar sistemas enzimáticos también puede ser aplicable a estructuras organometálicas ordenadas. Dando un paso adelante, los sistemas son tan efectivos para transferir los productos catalíticos dentro del proceso de cascada acoplada como para transformarlos. Por lo tanto, si los objetivos mencionados anteriormente se desafían a sí mismos, descubrir si la actividad biocatalítica de diferentes MOF de metaloenzimas se puede acoplar en un modo en cascada será un concepto fascinante para explorar más allá de la frontera de investigación actual.
Agradecimientos
Los autores agradecen el apoyo económico del Ministerio de Economía y Competitividad (MINECO) a través de los proyectos MAT2016-76739-R (AEI / FEDER, EU) y MAT2016-76039-C4-3-R (AEI / FEDER, UE) (incluido FEDER apoyo financiero) y de los Departamentos de Industria y Educación del Gobierno Vasco en el marco de los programas ELKARTEK, HAZITEK y PIBA (PIBA-2018-06), respectivamente. También se reconoce el proyecto INDESMOF de Investigación e Innovación de la Comisión Europea H2020-MSCA-RISE-2017 (Ref .: 778412). Ainara Valverde agradece al Gobierno Vasco (Departamento de Educación) su beca de doctorado (PREB_2018_1_004). Leire Celaya-Azcoaga agradece a la Universidad del País Vasco la beca de doctorado. Los autores agradecen el apoyo técnico y humano brindado por SGIker (UPV / EHU).
Referencias
(1) Heux, S.; Meynial-Salles, I.; O’Donohue, M. J.; Dumon, C. White Biotechnology: State of the Art Strategies for the Development of Biocatalysts for Biorefining. Biotechnology Advances 2015, 33 (8), 1653–1670.
(2) Commision, E. The European Green Deal. COMMUNICATION FROM THE COMMISSION TO THE EUROPEAN PARLIAMENT, THE EUROPEAN COUNCIL, THE COUNCIL, THE EUROPEAN ECONOMIC AND SOCIAL COMMITTEE AND THE COMMITTEE OF THE REGIONS 2019.
(3) Desage-El Murr, M. Nature Is the Cure: Engineering Natural Redox Cofactors for Biomimetic and Bioinspired Catalysis. ChemCatChem 2020, 12 (1), 53–62.
(4) Zastrow, M. L.; Pecoraro, V. L. Designing Functional Metalloproteins: From Structural to Catalytic Metal Sites. Coordination Chemistry Reviews 2013, 257 (17–18), 2565–2588.
(5) Fontecilla-Camps, J. C.; Amara, P.; Cavazza, C.; Nicolet, Y.; Volbeda, A. Structure-Function Relationships of Anaerobic Gas-Processing Metalloenzymes. Nature 2009, 460 (7257), 814–822.
(6) Moura, I.; Pauleta, S. R.; Moura, J. J. G. Enzymatic Activity Mastered by Altering Metal Coordination Spheres. Journal of Biological Inorganic Chemistry 2008, 13 (8), 1185–1195.
(7) Ji, Z.; Wang, H.; Canossa, S.; Wuttke, S.; Yaghi, O. M. Pore Chemistry of Metal–Organic Frameworks. Advanced Functional Materials 2020, 30 (41), 2000238.
(8) Waldron, K. J.; Rutherford, J. C.; Ford, D.; Robinson, N. J. Metalloproteins and Metal Sensing. Nature 2009, 460 (7257), 823–830.
(9) Thompson, Z.; Cowan, J. A. Artificial Metalloenzymes: Recent Developments and Innovations in Bioinorganic Catalysis. Small 2020, 16 (27), 2000392.
(10) Wei, T. H.; Wu, S. H.; Huang, Y. Da; Lo, W. S.; Williams, B. P.; Chen, S. Y.; Yang, H. C.; Hsu, Y. S.; Lin, Z. Y.; Chen, X. H.; Kuo, P. E.; Chou, L. Y.; Tsung, C. K.; Shieh, F. K. Rapid Mechanochemical Encapsulation of Biocatalysts into Robust Metal–Organic Frameworks. Nature Communications 2019, 10 (1), 1–8.
(11) Davis, H. J.; Ward, T. R. Artificial Metalloenzymes: Challenges and Opportunities. ACS Central Science 2019, 5 (7), 1120–1136.
(12) Freund, R.; Canossa, S.; Cohen, S. M.; Yan, W.; Deng, H.; Guillerm, V.; Eddaoudi, M.; Madden, D. G.; Fairen-Jimenez, D.; Lyu, H.; Macreadie, L. K.; Ji, Z.; Zhang, Y.; Wang, B.; Haase, F.; Wöll, C.; Zaremba, O.; Andreo, J.; Wuttke, S.; Diercks, C. S. 25 Years of Reticular Chemistry. Angewandte Chemie International Edition 2021.
(13) Peng, J.; Wu, R. Metal–Organic Frameworks in Proteomics/Peptidomics-A Review. Analytica Chimica Acta 2018, 1027, 9–21.
(14) Cohen, S. M. Postsynthetic Methods for the Functionalization of Metal-Organic Frameworks. Chemical Reviews 2012, 112 (2), 970–1000.
(15) Serre, C.; Devic, T. Iron and Groups V- and VI-Based MOFs. The Chemistry of Metal–Organic Frameworks: Synthesis, Characterization, and Applications 2016, 171–202.
(16) Sun, Q.; Aguila, B.; Ma, S. Metalloenzyme Mimicry at the Nodes of Metal-Organic Frameworks. Chem 2018, 4 (12), 2736–2738.
(17) Xiao, D. J.; Bloch, E. D.; Mason, J. A.; Queen, W. L.; Hudson, M. R.; Planas, N.; Borycz, J.; Dzubak, A. L.; Verma, P.; Lee, K.; Bonino, F.; Crocellà, V.; Yano, J.; Bordiga, S.; Truhlar, D. G.; Gagliardi, L.; Brown, C. M.; Long, J. R. Oxidation of Ethane to Ethanol by N2 O in a Metal-Organic Framework with Coordinatively Unsaturated Iron(II) Sites. Nature Chemistry 2014, 6 (7), 590–595.
(18) Ikuno, T.; Zheng, J.; Vjunov, A.; Sanchez-Sanchez, M.; Ortuño, M. A.; Pahls, D. R.; Fulton, J. L.; Camaioni, D. M.; Li, Z.; Ray, D.; Mehdi, B. L.; Browning, N. D.; Farha, O. K.; Hupp, J. T.; Cramer, C. J.; Gagliardi, L.; Lercher, J. A. Methane Oxidation to Methanol Catalyzed by Cu-Oxo Clusters Stabilized in NU-1000 Metal-Organic Framework. Journal of the American Chemical Society 2017, 139 (30), 10294–10301.
(19) Zheng, J.; Ye, J.; Ortuño, M. A.; Fulton, J. L.; Gutiérrez, O. Y.; Camaioni, D. M.; Motkuri, R. K.; Li, Z.; Webber, T. E.; Mehdi, B. L.; Browning, N. D.; Penn, R. L.; Farha, O. K.; Hupp, J. T.; Truhlar, D. G.; Cramer, C. J.; Lercher, J. A. Selective Methane Oxidation to Methanol on Cu-Oxo Dimers Stabilized by Zirconia Nodes of an NU-1000 Metal-Organic Framework. Journal of the American Chemical Society 2019, 141 (23), 9292–9304.
(20) Baek, J.; Rungtaweevoranit, B.; Pei, X.; Park, M.; Fakra, S. C.; Liu, Y. S.; Matheu, R.; Alshmimri, S. A.; Alshehri, S.; Trickett, C. A.; Somorjai, G. A.; Yaghi, O. M. Bioinspired Metal-Organic Framework Catalysts for Selective Methane Oxidation to Methanol. Journal of the American Chemical Society 2018, 140 (51), 18208–18216.
(21) Pullen, S.; Fei, H.; Orthaber, A.; Cohen, S. M.; Ott, S. Enhanced Photochemical Hydrogen Production by a Molecular Diiron Catalyst Incorporated into a Metal-Organic Framework. Journal of the American Chemical Society 2013, 135 (45), 16997–17003.
(22) Wu, J.; Wang, Z.; Jin, X.; Zhang, S.; Li, T.; Zhang, Y.; Xing, H.; Yu, Y.; Zhang, H.; Gao, X.; Wei, H. Hammett Relationship in Oxidase-Mimicking Metal–Organic Frameworks Revealed through a Protein-Engineering-Inspired Strategy. Advanced Materials 2021, 33 (3), 2005024.
(23) Gil-San-Millan, R.; López-Maya, E.; Platero-Prats, A. E.; Torres-Pérez, V.; Delgado, P.; Augustyniak, A. W.; Kim, M. K.; Lee, H. W.; Ryu, S. G.; Navarro, J. A. R. Magnesium Exchanged Zirconium Metal-Organic Frameworks with Improved Detoxification Properties of Nerve Agents. Journal of the American Chemical Society 2019, 141 (30), 11801–11805.
Autores
Itziar Oyarzabal 1,2, Ainara Valverde 1,3, Leire Celaya-Azcoaga 1,4 & Roberto Fernández de Luis 1
1BCMaterials, Basque Center for Materials, Applications and Nanostructures, UPV/EHU Science Park, 48940 Leioa, Spain
2IKERBASQUE, Basque Foundation for Science, 48013 Bilbao, Spain
3Department of Physical Chemistry (Macromolecular Chemistry Group (LABQUIMAC).
4Department of Inorganic Chemistry. Faculty of Science and Technology. University of the Basque Country (UPV/EHU). Barrio Sarriena s/n 48940 Leioa, Spain, 48013 Bilbao, Spain.
Este artículo fue publicado originalmente en Mapping Ignorance. Lea el original.
Traducido por: Gabriel Ibrahin Tovar (Universidad de Buenos Aires, Argentina)